技术支持
ELISA常用方法+常见问题问答
点击下载附件附件
ELISA常用方法+常见问题问答
ELISA原理及类型
ELISA是一种广泛应用在测定液体样本中的蛋白、抗体、或激素的免疫分析技术。酶联免疫吸附试验的标准程序,通常是把蛋白、抗体、或激素等(即抗原)直接或是以捕捉抗体(capture Ab)固定在固相载体上,再加入一级检测抗体(primarydetection Ab),形成一个抗原抗体的复合物。如果该抗体已经用酶(enzyme)标记了,即可用来直接测定抗原的量,若无,则可利用另一个酶标记的二级抗体来测定抗原的量。测定抗原量的方法是加入该酶的底质(substrate),作用后产生出现的颜色深浅和样本中的抗原量呈正比的关系,依此原理计算出样本中的抗原总量或浓度。
1.直接法(direct ELISA)
将抗原直接固定在固相载体上,加入酶标记的一级抗体,即可测定抗原总量,此一级抗体的特异性非常重要。
优势:操作手续简短,因无须使用二抗可避免交互反应。
缺点:试验中的一抗都得用酶标记,但不是每种抗体都适合做标记,费用相对提高。
2.间接法(indirect ELISA)
此测定方法与直接法类似,差别在于一级抗体没有酶标记,改用酶标记的二级抗体去辨识一级抗体来测定抗原量。
优势:二抗可以加强信号,而且有多种选择能做不同的测定分析。不加酶标记的一级抗体则能保留它最多的免疫反应性。
缺点:交互反应发生的机率较高。
3.双抗体夹心法(sandwich ELISA)
被检测的抗原包被在两个抗体之间,其中一个抗体将抗原固定于固相载体上,即捕捉抗体。另一个则是检测抗体,此抗体可用酶标记后直接测定抗原的量;或不标记,再透过酶标记的二级抗体来测定抗原的量。这两种抗体必须小心选取,才可避免交互反应或竞争相同的抗原结合部位。
优势:高灵敏、高专一性,抗原无须事先纯化。
缺点:抗原一定得拥有两个以上的抗体结合部位。
4.竞争法(competitive ELISA)
样本里的抗原(自由抗原)和纯化并固定在固相载体上的抗原(固定抗原)一起竞争相同的抗体,当样品里的自由抗原越多,就可以结合越多的抗体,而固定抗原就只能结合到较少的抗体,反之亦然。经清洗步骤,洗去自由抗原和抗体的复合物,只留下固定抗原和抗体的复合物,拿来与只有固定抗原的对照组结果相比较,根据呈色差异就可计算出样品里的抗原含量。
优势:可适用比较不纯的样本,而且数据再现性很高。
缺点:整体的敏感性和专一性都较差。
5.最新ELISA技术
基于细胞法(cell-based ELISA):是一种新的定性蛋白检测技术,将细胞直接在微孔板里培养,待检测时,不需抽提蛋白和裂解细胞,便可直接测量微孔板里蛋白经刺激或抑制作用后的变化。
优势:无需裂解细胞,所以目标蛋白损失最少,可测定完整细胞、黏附细胞、还有非粘附细胞。
缺点:不能测定抗原量。
ELISA实验中可能影响结果的原因及解决方法
样品收集和保存
用于ELISA测定最常用的临床标本是血清(浆)。要注意避免严重溶血,因为血红蛋白中含有具有类似过氧化物活性的血红素基团,在孵育时很容易吸附于固相,与HRP底物反应产生假阳性。
样品采集及血清分离中要注意避免细菌污染,一方面细菌分泌的酶可能对抗原抗体等蛋白产生分解作用,另一方面,细菌的内源性酶如大肠杆菌的β-半乳糖苷酶会对相应酶作标记的测定方法产生非特异性干扰。
样品应该要避免反复冻融。因反复冻融所产生的机械剪切力对标本中的蛋白等分子产生破坏作用,从而引起假阴性结果。另外,样品混匀时,不要剧烈振荡,反复颠倒混匀即可。
一般而言,如果在收集样品的当天进行检测,可将样品及时储存在4℃备用;而对隔天再检测的样本,应及时分装后冻存在-20℃备用,若要长期保存样品,最好将其置于-70℃冻存。
试剂准备
在实验开始前,需将试剂盒从冰箱中拿出来在室温放置20min,再进行测定,以使试剂盒在使用前与室温平衡,也可使温育时反应孔内的温度能较快的达到所要求的高度,以满足测定要求。 其次,目前商品中ELISA试剂盒中的洗板液均需在实验过程中对其所提供的浓缩液进行稀释配制,因此稀释时所用的蒸馏水或去离子水应该保证质量。此外,底物反应液应该反应显色前进行现配现用。同时,为了保证实验的均一性,实验中所有试剂在加样前必须摇匀。
加样
因ELISA的灵敏度较高,则应该按规定将血清稀释至适当的倍数,以降低非特异性反应,使特异性的抗原抗体反应充分体现出来。 加样品时,单孔用量要求:≥20ul/指标,如需要做2个复孔则血量≥60ul/指标。如果用量充足,最好提供50ul/孔/指标。具体用量也需根据试剂盒的要求而定。 吸取样品时,加样枪头不应粘附多余的液体;加样时不可90度向孔中滴加液体,否则会导致液体残留在吸头上,加样不准确。正确加样方法应为45度,吸头贴着孔壁和液面的交界处加入。加样时速度不可过快,否则无法保证微量加样的准确性和均一性;要避免样品加在孔壁上部而产生非特异性吸附。不可将样品溅出以避免对邻近孔产生污染。
孵育
一般,孵育时间与温度成反比,即温度越高,所需时间相对较短。最常用的孵育温度为37℃,孵育1-2h。 孵育时应贴封片或加盖,避免样品或稀释液蒸发,吸附于孔壁,难于清洗。孵育时,反应板不宜叠放,以保证各板的温度都能迅速平衡。同时,应严格控制孵育时间,避免因时间过长导致紧附于反应孔周围的非特异性结合。 孵育时,要尽量排除“边缘效应”,即96孔板的外周孔显色较中心孔深。究其原因,是因为96孔板周孔与中心孔的表面或热力学特征不同。因此,可采用水浴或在将反应溶液加入至板孔中时,将板和溶液均加热至孵育温度(37℃)。
洗板
为了确保ELISA测定的特异性,洗板可清除非特异性结合物质,减少背景信号,增加分析的信噪比。 手工洗板时,拍板要垂直,避免交叉污染,用力不能过猛,防止抗原抗体复合物脱离。使用半自动洗板时,应经常检查冲洗头是否通畅,若被杂物堵塞时可用注射器针头挑出。为了达到较好的洗涤效果,实验室可采用机器与人工洗涤相结合的方法,即在机器洗涤后再进行人工洗板1-2次。 以HRP作为标记酶的ELISA试剂盒中使用的洗板液一般为含0.05% Tween20的中性PBS,其中,吐温20的浓度可在0.05%-0.2%之间,高于0.2%时,可使包被在固相上的抗原或抗体解吸附而减低实验的灵敏度。
显色
目前以HRP作为标记酶的商品ELISA试剂盒中,如以TMB为底物,则提供的底物为A和B两瓶应用液;如以OPD为底物,则试剂盒提供OPD片剂或粉剂,临用前配制。显色剂配制后放置时间过长(肉眼可见浅蓝色的TMB时)要弃之不用。在加入底物开始显色反应前,最好是先检查一下底物溶液的有效性,即可将A和B两种液各加一滴于清洁的空板孔或eppendorf管中,观察是否有显色出现,如有,则说明底物已变质。 显色反应条件一般为37℃或室温反应15-30分钟。加终止液时,要避免气泡产生而引起的假阳性。
读板
读板时要保证酶标板清洁,同时也要注意酶标仪的波长是否已调至合适或所用滤光片是否正确。 通常,单波长读板的测定值一般是指以对显色具有最大吸收的波长如450nm或492nm进行比色测定;而双波长读板的测定值一般是敏感波长如450nm的吸光值与非敏感波长下如630nm的吸光值之差,可排除板内脏物的影响。同时,由于ELISA测定中单个空白孔的非特异吸收上有一定程度的不确定性,也就是说每次测定或同次测定空白孔位置的不同均有可能得到不同吸光度测定值,故而在ELISA测定比色时,最好是使用双波长比色。
数据结果分析
ELISA的测定结果可分为两种:定性测定和定量测定。前者只需确定阴性或阳性即可;后者则需要给具体的数值。在定量测定中,经常要将标准品所获得的吸光值进行标准曲线的绘制。
下面则简单介绍用excel绘制标准曲线的方法:
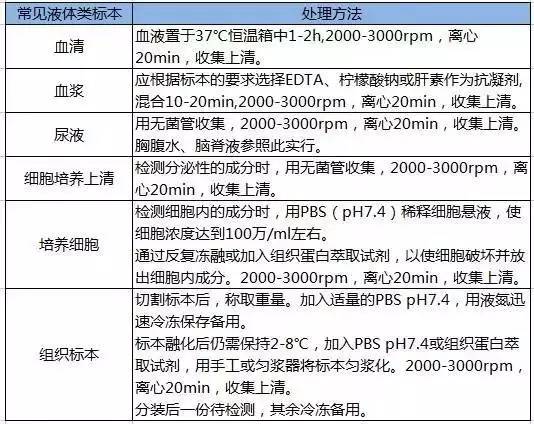
1)输入相应数据
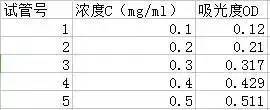
2)选中相应数据
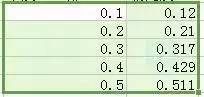
3)选择表格中,菜单栏中的插入散点图中第一个类型
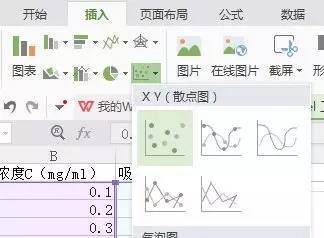
4)选中“图表工具”中的“快速布局”中fx图标,即可得到以下图表。Excel版本较低的可以直接跳到第6)步。
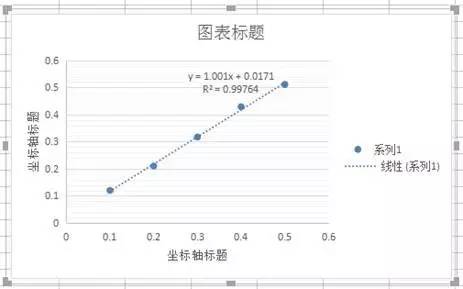
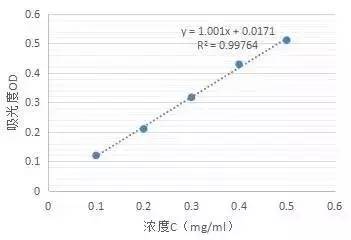
5)点中坐标轴标题,可做修改。修改后可获得以下标准曲线。
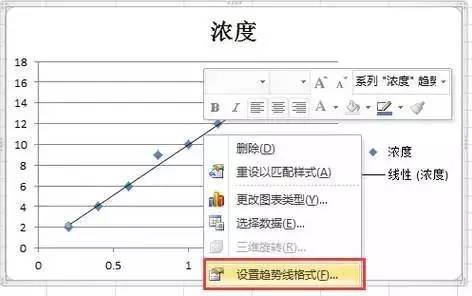
6)或者在较低版本的excel中,在“图表工具”选项中,选择趋势线|线性趋势线。
7)选中图表中的趋势线,右键,选择“设置趋势线格式”,在弹出的对话框中,将“显示公式”勾选上,点击关闭,也获得标准曲线。
8)可将试验管中所测的吸光度值代入图表中的公式Y=1.001x+0.0171后可得到所求成分的含量,即X的值。
ELISA的疑难杂症
1)显色浅,灵敏度低
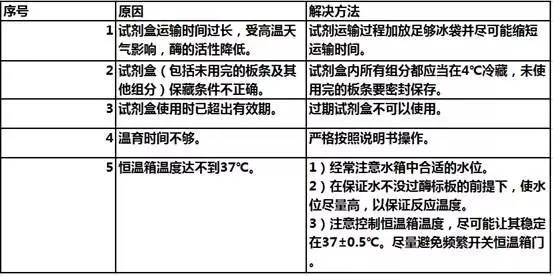
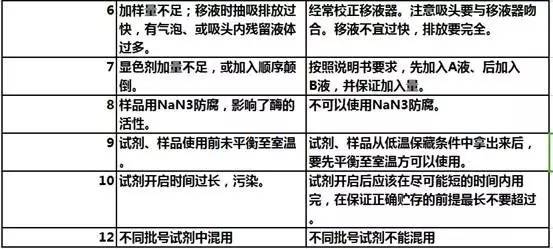
2)假阳性多,本底高甚至花板
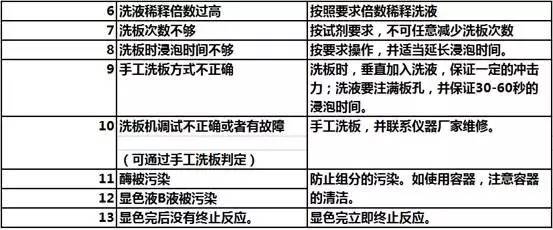
3)重复性不好
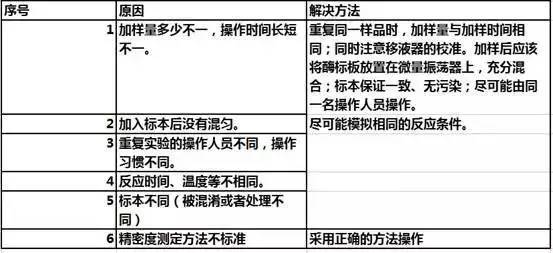
4)白板
ELISA原理及类型
ELISA是一种广泛应用在测定液体样本中的蛋白、抗体、或激素的免疫分析技术。酶联免疫吸附试验的标准程序,通常是把蛋白、抗体、或激素等(即抗原)直接或是以捕捉抗体(capture Ab)固定在固相载体上,再加入一级检测抗体(primarydetection Ab),形成一个抗原抗体的复合物。如果该抗体已经用酶(enzyme)标记了,即可用来直接测定抗原的量,若无,则可利用另一个酶标记的二级抗体来测定抗原的量。测定抗原量的方法是加入该酶的底质(substrate),作用后产生出现的颜色深浅和样本中的抗原量呈正比的关系,依此原理计算出样本中的抗原总量或浓度。
1.直接法(direct ELISA)
将抗原直接固定在固相载体上,加入酶标记的一级抗体,即可测定抗原总量,此一级抗体的特异性非常重要。
优势:操作手续简短,因无须使用二抗可避免交互反应。
缺点:试验中的一抗都得用酶标记,但不是每种抗体都适合做标记,费用相对提高。
2.间接法(indirect ELISA)
此测定方法与直接法类似,差别在于一级抗体没有酶标记,改用酶标记的二级抗体去辨识一级抗体来测定抗原量。
优势:二抗可以加强信号,而且有多种选择能做不同的测定分析。不加酶标记的一级抗体则能保留它最多的免疫反应性。
缺点:交互反应发生的机率较高。
3.双抗体夹心法(sandwich ELISA)
被检测的抗原包被在两个抗体之间,其中一个抗体将抗原固定于固相载体上,即捕捉抗体。另一个则是检测抗体,此抗体可用酶标记后直接测定抗原的量;或不标记,再透过酶标记的二级抗体来测定抗原的量。这两种抗体必须小心选取,才可避免交互反应或竞争相同的抗原结合部位。
优势:高灵敏、高专一性,抗原无须事先纯化。
缺点:抗原一定得拥有两个以上的抗体结合部位。
4.竞争法(competitive ELISA)
样本里的抗原(自由抗原)和纯化并固定在固相载体上的抗原(固定抗原)一起竞争相同的抗体,当样品里的自由抗原越多,就可以结合越多的抗体,而固定抗原就只能结合到较少的抗体,反之亦然。经清洗步骤,洗去自由抗原和抗体的复合物,只留下固定抗原和抗体的复合物,拿来与只有固定抗原的对照组结果相比较,根据呈色差异就可计算出样品里的抗原含量。
优势:可适用比较不纯的样本,而且数据再现性很高。
缺点:整体的敏感性和专一性都较差。
5.最新ELISA技术
基于细胞法(cell-based ELISA):是一种新的定性蛋白检测技术,将细胞直接在微孔板里培养,待检测时,不需抽提蛋白和裂解细胞,便可直接测量微孔板里蛋白经刺激或抑制作用后的变化。
优势:无需裂解细胞,所以目标蛋白损失最少,可测定完整细胞、黏附细胞、还有非粘附细胞。
缺点:不能测定抗原量。
ELISA实验中可能影响结果的原因及解决方法
样品收集和保存
用于ELISA测定最常用的临床标本是血清(浆)。要注意避免严重溶血,因为血红蛋白中含有具有类似过氧化物活性的血红素基团,在孵育时很容易吸附于固相,与HRP底物反应产生假阳性。
样品采集及血清分离中要注意避免细菌污染,一方面细菌分泌的酶可能对抗原抗体等蛋白产生分解作用,另一方面,细菌的内源性酶如大肠杆菌的β-半乳糖苷酶会对相应酶作标记的测定方法产生非特异性干扰。
样品应该要避免反复冻融。因反复冻融所产生的机械剪切力对标本中的蛋白等分子产生破坏作用,从而引起假阴性结果。另外,样品混匀时,不要剧烈振荡,反复颠倒混匀即可。
一般而言,如果在收集样品的当天进行检测,可将样品及时储存在4℃备用;而对隔天再检测的样本,应及时分装后冻存在-20℃备用,若要长期保存样品,最好将其置于-70℃冻存。

试剂准备
在实验开始前,需将试剂盒从冰箱中拿出来在室温放置20min,再进行测定,以使试剂盒在使用前与室温平衡,也可使温育时反应孔内的温度能较快的达到所要求的高度,以满足测定要求。 其次,目前商品中ELISA试剂盒中的洗板液均需在实验过程中对其所提供的浓缩液进行稀释配制,因此稀释时所用的蒸馏水或去离子水应该保证质量。此外,底物反应液应该反应显色前进行现配现用。同时,为了保证实验的均一性,实验中所有试剂在加样前必须摇匀。
加样
因ELISA的灵敏度较高,则应该按规定将血清稀释至适当的倍数,以降低非特异性反应,使特异性的抗原抗体反应充分体现出来。 加样品时,单孔用量要求:≥20ul/指标,如需要做2个复孔则血量≥60ul/指标。如果用量充足,最好提供50ul/孔/指标。具体用量也需根据试剂盒的要求而定。 吸取样品时,加样枪头不应粘附多余的液体;加样时不可90度向孔中滴加液体,否则会导致液体残留在吸头上,加样不准确。正确加样方法应为45度,吸头贴着孔壁和液面的交界处加入。加样时速度不可过快,否则无法保证微量加样的准确性和均一性;要避免样品加在孔壁上部而产生非特异性吸附。不可将样品溅出以避免对邻近孔产生污染。
孵育
一般,孵育时间与温度成反比,即温度越高,所需时间相对较短。最常用的孵育温度为37℃,孵育1-2h。 孵育时应贴封片或加盖,避免样品或稀释液蒸发,吸附于孔壁,难于清洗。孵育时,反应板不宜叠放,以保证各板的温度都能迅速平衡。同时,应严格控制孵育时间,避免因时间过长导致紧附于反应孔周围的非特异性结合。 孵育时,要尽量排除“边缘效应”,即96孔板的外周孔显色较中心孔深。究其原因,是因为96孔板周孔与中心孔的表面或热力学特征不同。因此,可采用水浴或在将反应溶液加入至板孔中时,将板和溶液均加热至孵育温度(37℃)。
洗板
为了确保ELISA测定的特异性,洗板可清除非特异性结合物质,减少背景信号,增加分析的信噪比。 手工洗板时,拍板要垂直,避免交叉污染,用力不能过猛,防止抗原抗体复合物脱离。使用半自动洗板时,应经常检查冲洗头是否通畅,若被杂物堵塞时可用注射器针头挑出。为了达到较好的洗涤效果,实验室可采用机器与人工洗涤相结合的方法,即在机器洗涤后再进行人工洗板1-2次。 以HRP作为标记酶的ELISA试剂盒中使用的洗板液一般为含0.05% Tween20的中性PBS,其中,吐温20的浓度可在0.05%-0.2%之间,高于0.2%时,可使包被在固相上的抗原或抗体解吸附而减低实验的灵敏度。
显色
目前以HRP作为标记酶的商品ELISA试剂盒中,如以TMB为底物,则提供的底物为A和B两瓶应用液;如以OPD为底物,则试剂盒提供OPD片剂或粉剂,临用前配制。显色剂配制后放置时间过长(肉眼可见浅蓝色的TMB时)要弃之不用。在加入底物开始显色反应前,最好是先检查一下底物溶液的有效性,即可将A和B两种液各加一滴于清洁的空板孔或eppendorf管中,观察是否有显色出现,如有,则说明底物已变质。 显色反应条件一般为37℃或室温反应15-30分钟。加终止液时,要避免气泡产生而引起的假阳性。
读板
读板时要保证酶标板清洁,同时也要注意酶标仪的波长是否已调至合适或所用滤光片是否正确。 通常,单波长读板的测定值一般是指以对显色具有最大吸收的波长如450nm或492nm进行比色测定;而双波长读板的测定值一般是敏感波长如450nm的吸光值与非敏感波长下如630nm的吸光值之差,可排除板内脏物的影响。同时,由于ELISA测定中单个空白孔的非特异吸收上有一定程度的不确定性,也就是说每次测定或同次测定空白孔位置的不同均有可能得到不同吸光度测定值,故而在ELISA测定比色时,最好是使用双波长比色。
数据结果分析
ELISA的测定结果可分为两种:定性测定和定量测定。前者只需确定阴性或阳性即可;后者则需要给具体的数值。在定量测定中,经常要将标准品所获得的吸光值进行标准曲线的绘制。
下面则简单介绍用excel绘制标准曲线的方法:
1)输入相应数据

2)选中相应数据

3)选择表格中,菜单栏中的插入散点图中第一个类型

4)选中“图表工具”中的“快速布局”中fx图标,即可得到以下图表。Excel版本较低的可以直接跳到第6)步。


5)点中坐标轴标题,可做修改。修改后可获得以下标准曲线。

6)或者在较低版本的excel中,在“图表工具”选项中,选择趋势线|线性趋势线。
7)选中图表中的趋势线,右键,选择“设置趋势线格式”,在弹出的对话框中,将“显示公式”勾选上,点击关闭,也获得标准曲线。

8)可将试验管中所测的吸光度值代入图表中的公式Y=1.001x+0.0171后可得到所求成分的含量,即X的值。
ELISA的疑难杂症
1)显色浅,灵敏度低


2)假阳性多,本底高甚至花板

3)重复性不好

4)白板

