技术支持
WB实验背景很脏是什么原因?该如何解决?
Western Blot实验可以说是生物专业最基本的实验了,然而,虽然WB实验天天做,但是正常高清的的结果大图并不是你想有就能有。
WB实验出现最多问题的,应该就是背景的问题了。
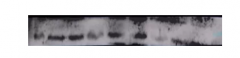
你想一下,好不容易实验过五关斩六将做到最后一步,结果一看,是这样的:

那真的是让人非常郁闷了。
为什么明明跑出了趋势,但就是背景脏?怎么让自己的条带不因脏脏的背景而毁了呢?
这里要清楚一点,背景脏不一定是因为仪器不干净造成的,也有可能是蛋白降解或者整个实验过程中条件不对造成的,有可能是以下的环节出了问题:
1、实验准备
提取蛋白所需的研磨器材,以及电泳仪的玻璃板、梳子要清洗干净;
若长期不使用,建议玻璃板之间用纸隔开,或者放在置物架上,避免长期放置后,玻璃板黏连在一起。
2、提取蛋白
选择合适的蛋白裂解液,充分去除一些干扰因素,比如核酸,多糖,脂类等;
建议蛋白分装在0.2ml的Ep管中,避免反复冻融使某些蛋白发生改变;
同时要注意Loading buffer的保质期,每次加完之后要充分混匀,再去煮沸。
3、制胶
玻璃板夹紧之后,我们会习惯性加水试一下是否漏胶,建议用蒸馏水而不是自来水测试,测试结束后要将玻璃板之间的水倒干净,用滤纸吸干残留的水;
灌胶之前要将配好的试剂充分混匀,灌胶的过程中要掌握好速度,缓慢加样,避免产生气泡,
然后缓缓加入无水乙醇封胶,该步操作时速度一定要慢,防止把胶面冲变形;在等待分离胶凝固的过程中,不要总去摇晃观察,
温度较高的情况下,30min左右就会凝固,冬天气温较低可能需要较长时间。
分离胶液面不平,也会影响后期蛋白电泳的效果。
4、转膜
转膜前需在一张转膜板两侧各放置3-4张滤纸(两侧数量相同)。
切记不要用手直接接触PVDF膜和滤纸,手上的油脂会对其造成污染,同时要佩戴干净的手套,全程尽量使用镊子夹取。
同时要赶走每一层之间的气泡。
5、转膜
转膜时要使整个机器之余冰水混合物中,我们常用220V或者其他高电压进行,
机器温度升高,会使蛋白降解,也就是我们转膜后,用丽春红染色发现条带跑糊,发光后条带和背景都会脏的一塌糊涂。
6、孵育抗体
我们孵育一抗的时间大多会选择4度过夜,但是具体多长时间算合适,其实没有硬性规定。
但是二抗孵育的时间不宜过长,一般是室温下摇床孵育两小时,并要清洗干净,否则显影效果,背景会脏。
7、发光液配置
像大部分实验室使用的ECL发光液,A液和B液按照1:1的比例配置,
发光液要求现用现配,每次根据使用量合理配置用液量,
发光液配置时间过长同样会引起发光效果不好,背景脏或者漆黑一片。

